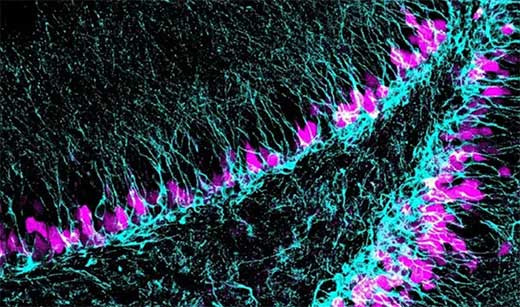
Investigadores descubren un gen clave que controla el desarrollo de células implicadas en la memoria y el aprendizaje
MADRID 14 Ago. (EUROPA PRESS) - Una investigación del Centro de Neurociencias Cajal-CSIC de Madrid ha descubierto un nuevo mecanismo (el gen 'Sox5') que controla cómo se generan las células madre neurales adultas durante el desarrollo del giro dentado, una región del hipocampo implicada en la memoria y el aprendizaje.
El estudio, liderado por la responsable del Laboratorio de Control Molecular de la Neurogénesis, la doctora Aixa Morales, se ha llevado a cabo en ratones y se centra en estas células neurales que permanecen en un estado de reposo conocido como quiescencia, en el que no son células maduras ni tampoco se dividen para generar neuronas, pero en el que pueden activarse cuando es necesario. Esta estrategia "de reposo" garantiza que no se agoten de forma prematura.
Lo que no se conocía bien hasta ahora era qué mecanismos aseguran que su entrada en quiescencia sea correcta y reversible. Así, este trabajo demuestra que el gen 'Sox5' es "crucial" para establecer ese estado de reposo de forma equilibrada, afirman los autores. Estudios previos habían demostrado que 'Sox5' es importante para la neurogénesis adulta, y, ahora, esta investigación muestra que también es necesario para la formación de las propias células madre neurales durante el desarrollo del giro dentado.
Por otro lado, los resultados del estudio publicado en 'PLOS Biology' también revelan que la vía de señalización BMP (Bone Morphogenetic Proteins), clave en el desarrollo embrionario, se encuentra sobreactivada cuando falta 'Sox5'. La vía BMP promueve la quiescencia, y en ausencia de 'Sox5' se desregula y esto impide mantener el equilibrio necesario entre reposo y activación de las células madre.
"Inhibiendo esta vía con pequeñas moléculas que se inyectaron en los ratones que carecían de 'Sox5', se logró revertir algunas de las alteraciones que provoca la pérdida de este gen en las células madre neurales", explica la investigadora del Centro de Neurociencias Cajal y coautora del estudio, Paula Tirado. Así, este hallazgo abre la puerta a posibles estrategias terapéuticas dirigidas a modular la vía BMP en contextos de pérdida neuronal, como el envejecimiento o las enfermedades neurodegenerativas.
Asimismo, otro de los hallazgos relevantes es la identificación de una ventana temporal "crítica" durante la segunda semana después del nacimiento, en la que se establece el equilibrio adecuado entre dos estados de reposo de las células madre neurales: Un estado profundo que las mantiene inactivas durante largos periodos, y otro superficial, en el que están más cerca de activarse.
Durante esta ventana temporal, Sox5 limita la entrada de células madre neurales en reposo superficial; una actuación esencial para evitar una sobreproducción transitoria de neuronas en la juventud, lo que podría agotar la reserva de células madre, y por tanto, reducir la capacidad de regeneración del cerebro en la vida adulta, apuntan los autores.
Además, en humanos, mutaciones en el gen SOX5 están relacionadas con el síndrome de Lamb-Shaffer, una enfermedad rara que se manifiesta con trastornos del lenguaje, alteraciones cognitivas y rasgos del espectro autista. Este nuevo trabajo ofrece un marco para profundizar en los mecanismos celulares alterados en estos pacientes y explorar enfoques de tratamiento en el futuro, señala el estudio.
Igualmente, muestra la importancia de desentrañar las claves genéticas que promueven la neurogénesis adulta durante el desarrollo y abre la puerta al diseño de estrategias para activar las células madre neurales en situaciones de pérdida neuronal como ocurre en enfermedades neurodegenerativas, concluye.